INSTITUTO NACIONAL CENTRAL ÚNICO COORDINADOR DE ABLACIÓN E IMPLANTE
Resolución 327/2023
RESFC-2023-327-APN-D#INCUCAI
Ciudad de Buenos Aires, 25/09/2023
VISTO el EX-2023-01858161-APN-DM#INCUCAI, las disposiciones de la Ley Nº 27.447 de Trasplante de Órganos, Tejidos y Células, y su reglamentación aprobada por Decreto N° 16/2019 del Poder Ejecutivo Nacional; y
CONSIDERANDO
Que la Ley N° 27.447 tiene por objeto regular las actividades vinculadas a la obtención y utilización de órganos, tejidos y células de origen humano en todo el territorio de la República Argentina, incluyendo la investigación, promoción, donación, extracción, preparación, distribución, el trasplante y su seguimiento.
Que el INSTITUTO NACIONAL CENTRAL ÚNICO COORDINADOR DE ABLACIÓN E IMPLANTE (INCUCAI), en virtud de lo dispuesto en el artículo 3 del Decreto N° 16/2019 es la autoridad de aplicación del cuerpo legal citado precedentemente.
Que el artículo 39 de la Ley N° 27.447 establece que todo médico que certifique el fallecimiento de una persona debe iniciar el proceso de donación, conforme las normas que a dichos fines dicte el INCUCAI.
Que, respecto del fallecimiento, el artículo 36 ordena que el mismo puede certificarse tras el cese irreversible de las funciones circulatorias o de las funciones encefálicas, y que ambos se deben reconocer mediante un examen clínico adecuado tras un período apropiado de observación.
Que, asimismo, entre las responsabilidades que la Ley N° 27.447 le asigna al INCUCAI se encuentran las de dictar las normas técnicas a que deberá responder la obtención y utilización de órganos, tejidos y células para trasplante; como así también, aquellas relativas a la detección, selección y mantenimiento de potenciales donantes fallecidos, ablación, acondicionamiento y transporte.
Que merece destacarse, además, la competencia de este Organismo Nacional para entender en las actividades dirigidas al tratamiento de potenciales donantes fallecidos y en supervisar la correcta determinación del diagnóstico de muerte, ablación y acondicionamiento de los órganos, coordinando su acción con los Organismos Provinciales de Ablación e Implante (OPAI).
Que, en nuestro país, la donación de órganos para trasplante se realiza a partir de donantes fallecidos en unidades de terapia intensiva (UTI) a consecuencia de lesiones encefálicas catastróficas, con sostén artificial de funciones cardio respiratorias, es decir en muerte encefálica.
Que, sin embargo, el avance tecnológico generó la posibilidad de obtener órganos para trasplante de donantes cuyo fallecimiento se produjo por el cese irreversible de las funciones circulatorias, lo que se conoce como donación en asistolia, la cual ha sido categorizada en distintas modalidades o tipos, acorde al lugar y las circunstancias en las que se produjo el fallecimiento del paciente.
Que la posibilidad de donación de órganos, tanto después de la certificación de la muerte por el cese irreversible de las funciones encefálicas como de las circulatorias, requiere de requisitos y protocolos que normatizan las actividades dentro del marco legal vigente en cada país.
Que, en atención a ello, la Dirección Médica del INCUCAI ha elaborado el PROTOCOLO DE DONACIÓN EN ASISTOLIA con la finalidad de implementar y normatizar en nuestro país el proceso de extracción de órganos luego del fallecimiento de una persona, certificado mediante la determinación del cese irreversible de la función circulatoria.
Que dicho PROTOCOLO contempla la intervención y roles de los distintos actores del sistema de salud y del hospital que participan del proceso de donación en asistolia, como así también la descripción de los pasos ordenados y sucesivos que deben cumplir para llevar adelante el mismo.
Que en la propuesta se incluyeron las recomendaciones de las GUÍAS CLÍNICAS PARA LA CERTIFICACIÓN DE MUERTE EN PARO CIRCULATORIO y las recomendaciones en caso de no reanimación emitidas por la ORGANIZACIÓN MUNDIAL DE LA SALUD en el año 2014.
Que en la elaboración del PROTOCOLO participaron la SOCIEDAD ARGENTINA DE TRASPLANTE (SAT), la SOCIEDAD ARGENTINA DE TERAPIA INTENSIVA (SATI), y las COMISIONES ASESORAS DE TRASPLANTE RENAL Y TRASPLANTE HEPÁTICO del INCUCAI, efectuando cada una sus aportes en el ámbito de sus respectivas incumbencias.
Que, asimismo, el COMITÉ DE BIOÉTICA del INCUCAI tomo la intervención de su competencia sin objeciones que formular al respecto.
Que la COMISIÓN FEDERAL DE TRASPLANTES (COFETRA) ha brindado el asesoramiento previsto en el artículo 61 de la Ley N° 27.447, en la reunión llevada a cabo el día 13 de junio de 2022.
Que la DIRECCIÓN MÉDICA, la DIRECCIÓN CIENTÍFICO TÉCNICA y la DIRECCIÓN DE TECNOLOGÍAS Y SISTEMAS DE LA INFORMACIÓN han trabajado en la elaboración e implementación del protocolo propuesto y brindado sus informes técnicos pertinentes.
Que la DIRECCIÓN DE ASUNTOS JURÍDICOS del INCUCAI ha tomado la intervención de su competencia.
Que se actúa en uso de las facultades previstas por la Ley Nº 27.447, artículos 36, 39, 57 apartados 4, 13 y 19, y el artículo 3º del Decreto Nº 16/2019.
Que la medida que se adopta fue tratada en reunión de Directorio de fecha 25 de Septiembre de 2023, conforme surge del texto del Acta N° 30.
Por ello;
EL DIRECTORIO DEL INSTITUTO NACIONAL CENTRAL ÚNICO COORDINADOR DE ABLACIÓN E IMPLANTE
RESUELVE:
ARTÍCULO 1°.- Apruébese el PROTOCOLO DE DONACIÓN EN ASISTOLIA destinado a la obtención de órganos de personas fallecidas, cuya certificación se realiza mediante la determinación del cese irreversible de las funciones circulatorias, conforme a los fundamentos, actores intervinientes y algoritmo del proceso que se encuentran establecidos en el ANEXO I (IF- 2023-111890041-APN-DM#INCUCAI), que forma parte integrante de la presente resolución.
ARTICULO 2°.- Apruébese la GESTIÓN DE LISTA DE ESPERA – DISTRIBUCIÓN RENAL DEL DONANTE EN ASISTOLIA, de acuerdo a los criterios dispuestos en el ANEXO II (IF-2023-112558331-APN-DCT#INCUCAI) que también integra la presente.
ARTÍCULO 3°.- Las disposiciones establecidas en la presente resolución entrarán en vigencia el 2 de octubre de 2023.
ARTÍCULO 4°.- Regístrese, comuníquese. Dése a la DIRECCIÓN NACIONAL DEL REGISTRO OFICIAL para su publicación y archívese.
Richard Malan - Carlos Soratti
NOTA: El/los Anexo/s que integra/n este(a) Resolución se publican en la edición web del BORA -www.boletinoficial.gob.ar-
(Nota Infoleg: Los anexos referenciados en la presente norma han sido extraídos de la edición web de Boletín Oficial)
A.- INTRODUCCIÓN
La obtención de órganos para trasplante, en sus inicios, se realizó a partir de donantes fallecidos en unidades de terapia intensiva (UTI) a consecuencia de lesiones encefálicas catastróficas, con sostén artificial de funciones cardiorrespiratorias, es decir en muerte encefálica. Sin embargo, el avance tecnológico generó la posibilidad de obtener órganos para trasplante de donantes cuyo fallecimiento se produjo por el cese irreversible de las funciones circulatorias, lo que se conoce como donación en asistolia. En nuestro país, la Ley N° 27.447 de Trasplante de Órganos, Tejidos y Células ha incluido en el artículo 36 la certificación de muerte mediante la determinación del cese irreversible de las funciones circulatorias o del cese irreversible de las funciones encefálicas, según sea el caso.
Estas denominaciones quedaron plasmadas en la clasificación internacional como DBD (Donation after Brain Death) donación después de muerte encefálica, y DCD (Donation after Circulatory Death) donación después de muerte circulatoria.
La donación de órganos en asistolia (DCD) ha sido categorizada en distintas modalidades o tipos, acorde al lugar y las circunstancias en las que se produjo el fallecimiento del paciente.
La primera clasificación surgió en 1995 en la conferencia internacional Non Heart Beating Donation Conference, que tuvo lugar en la ciudad holandesa de Maastricht, generando cuatro (4) tipos de donantes en asistolia:
Esta clasificación original de Maastricht fue modificada en el año 2011 en Madrid, con el objetivo de incluir el término de donación en asistolia controlada o no controlada, dependiendo del momento y previsibilidad del fallecimiento en parada cardiocirculatoria. Se incluye a continuación el cuadro actualizado:

Se debe remarcar que la posibilidad de donación de órganos, tanto en DBD como en DCD, requiere de requisitos y protocolos que normatizan la actividad dentro del marco médico legal vigente en cada país y en el mundo.
En cuanto a la donación en asistolia, y tal como se ha señalado precedentemente, los países pioneros en su implementación han puesto en vigencia protocolos específicos que fueron utilizados y adecuados a cada realidad sanitaria. En lo que respecta particularmente al protocolo de donantes en asistolia controlada, conocido por sus siglas cDCD, hace referencia a la posibilidad de obtención de órganos de pacientes en los que se ha decidido el retiro de las medidas de soporte vital -adecuación del esfuerzo terapéutico (AET), es el denominado Tipo III de la clasificación de Maastricht. La toma de decisiones de adecuación terapéutica con retiro del soporte vital es, y debe ser, un proceso efectuado con carácter previo y completamente independiente de la posibilidad de donación de órganos posterior al fallecimiento. Dicho proceso es competencia pura y exclusiva del equipo de terapia intensiva en conjunto con las decisiones del paciente, o la subrogación de estas por parte de la familia, y se realiza en caso de padecer una enfermedad irreversible, incurable, o cuando se encuentre en estado terminal, o haya sufrido lesiones que lo coloquen en igual situación (art.59 inc.g Código Civil y Comericial de la Nación).
En la mayoría de los casos la posibilidad de donación de órganos luego de la parada circulatoria irreversible, en asistolia controlada, se concreta en pacientes con lesión cerebral gravísima, en coma profundo, que no cumplen los criterios de muerte encefálica, o en aquellos con otras patologías severas irrecuperables en los cuales los tratamientos son fútiles y, por ello, el equipo de salud plantea la posibilidad de adecuación de esfuerzo terapéutico y retiro del soporte vital.
En síntesis, la donación en asistolia es el proceso de extracción de órganos realizado luego del fallecimiento de una persona y certificado mediante la determinación del cese irreversible de la función circulatoria (art.36 Ley N° 27.447).
B.- DONACIÓN EN ASISTOLIA CONTROLADA (cDCD o Donación Maastricht III)
El presente protocolo tiene por objetivo normatizar la donación de órganos en asistolia, específicamente la denominada Asistolia Controlada o Tipo III de Maastricht y se circunscribirá en una primera etapa a la ablación de órganos abdominales. Para ello, se incluirá una descripción de los actores y el algoritmo del proceso.
I.- ACTORES DEL SISTEMA DE SALUD QUE PARTICIPAN DEL PROCESO Y ROLES
En el proceso de donación en asistolia controlada intervienen diferentes actores del sistema de salud y del hospital, cada uno de ellos con roles específicos. Se describen a continuación:
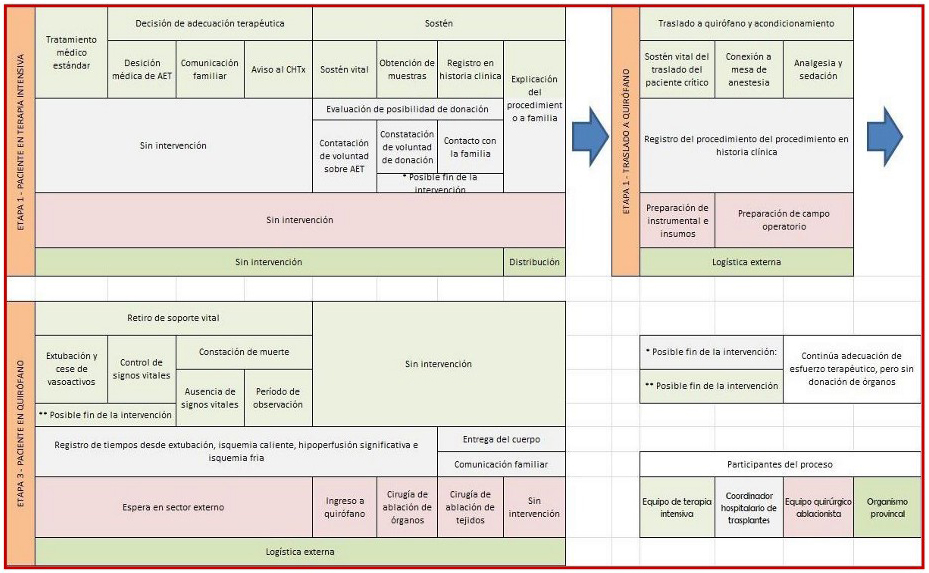
II. - ALGORITMO DEL PROCESO DE DONACIÓN EN ASISTOLIA CONTROLADA (cDCD)
En este apartado se describen todos los pasos ordenados y sucesivos del proceso de donación en asistolia controlada.
II.7.a). - Ablación de órganos abdominales (riñón e hígado y páncreas)
II.8. - LÍNEA DE TIEMPO PROGRAMA DE ASISTOLIA CONTROLADA
PLANILLA N° 1.
MODELO DE REGISTRO DE PARÁMETROS HEMODINÁMICOS

BIBLIOGRAFIA
1. ASTS American Society of Transplant Surgeons. “Recommended Practice Guidelines for Controlled Donation after Cardiac Death Organ Procurement and Transplantation“. Am J Transplant. 2009 Sep;9(9):2004-11. doi: 10.1111/j.1600- 6143.2009.02739.x. Disponible en: https://pubmed.ncbi.nlm.nih.gov/19624569/
2. Australian Governmento Organ and Tissue Authority. National Protocol forDonation after Cardiac Death july 2010. Disponible en: https://www.donatelife.gov.au/sites/default/files/DCD%20protocol%20020311- 0e4e2c3d-2ef5-4dff- b7ef-af63d0bf6a8a-1.PDF.
3. Beatriz Dominguez-Gil , Nancy Ascher, Alexander M. Capron, Dale Gardiner, Alexander R. Manara, James L. Bernat, Eduardo Minambres, Jeffrey M. Singh, Robert J. Porte, James F. Markmann, Kumud Dhital, Didier Ledoux, Constantino Fondevila, Sarah Hosgood, Dirk Van Raemdonck, Shaf Keshavjee, James Dubois, Andrew McGee, Galen V. Henderson, Alexandra K. Glazier, Stefan G. Tullius , Sam D. Shemie and Francis L. Delmonico. “Expanding controlled donation after the circulatory determination of death: statement from an international collaborative”. Conference Reports and expert panel. Intensive CareMed https://doi.org/10.1007/s00134-020-06341-7
4. Council fo Europe. EDQM European Directorate for the quality of medicines & Health Care. Guía para la calidad y la seguridad de órganos para el trasplante. 2016
5. J L Bernat, A M D'Alessandro, F K Port, T P Bleck, S O Heard, J Medina, S H Rosenbaum, M A Devita, R S Gaston, R M Merion, M L Barr, W H Marks, H Nathan, K O'connor, D L Rudow, A B Leichtman, P Schwab, N L Ascher, R A Metzger, V Mc Bride, W Graham, D Wagner, J Warren, F L Delmonico. “Report of a National Conference on Donation after Cardiac Death AJT” 2006. Am J Transplant. 2006 Feb;6(2):281-91. doi: 10.1111/j.1600-6143.2005.01194.x.
6. Cleveland Clinic Organ, Tissue and Eye Donation After Determination ofCirculatory Death Procedure. Disponible en: https://my.clevelandclinic.org/ccf/media/files/Bioethics/Organ_procurement_poli cy.pdf
7. Código Civil y Comercial de la Nación. Ley Nacional N° 26994. http://servicios.infoleg.gob.ar/infolegInternet/anexos/235000- 239999/235975/norma.htm
8. Ley Nacional de Trasplante de órganos, tejidos y células, Ley Nacional N° 27447.Disponible en: /normativa/nacional/ley-27447-2018-312715
9. Ley Nacional de Derechos del paciente , Ley Nacional N° 26529. Disponible en: http://servicios.infoleg.gob.ar/infolegInternet/anexos/160000- 164999/160432/texact.htm
10. OMS.WHO. Clinical Criteria for the Determination of Death. WHO Technical Expert Consultation. WHO Headquarters, Geneva, Switezerland. 22.23 september 2014. Disponible en: https://apps.who.int/iris/handle/10665/254737 y completo para descarga en: https://apps.who.int/iris/bitstream/handle/10665/254737/WHO-HIS-SDS-2017.5-eng.pdf?sequence=1&isAllowed=y
11. ONT. Organización Nacional de Trasplante. Ministerio de Sanidad y Consumo de España. Donación en Asistolia en España: situación actual y recomendaciones. Documento de Consenso Nacional 2012. Disponible en: http://www.ont.es/infesp/DocumentosDeConsenso/DONACI%C3%93N%20EN%20ASISTOLIA%20ENo/o20ESPAo/oC3o/o91A.o/o20SITUACIo/oC3o/o93No/o20ACT UAL%20Y%20RECOMENDACIONES.pdf
12. AR Manara; PG. Murphy and G. O'Callaghan. Donation after circulatory death. British Journal of Anaesthesia 108 (S1): i108-i121 (2012). doi:10.1093/bja/aer357. Disponible en: https://www.who.int/servicedeliverysafety/ddcr84.pdf
13. Marie Thoung, Angel Ruiz, Patrick Evrard, Michael Kuiper, Catherine Boffa, Mohammed Akhtar, James Neuberger and Rutger Ploeg. Review. New classification of donation after circulatory death donors definitions and terminology. Transplant International. 016 Jul;29(7):749-59.doi: 10.1111/tri.12776. Epub 2016 May 4. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26991858/
14. Perez Villares JM. Donación en asistolia Donation after circulatory determination of death. Cuad Med Forense 2015;21(1-2):43-49. Disponible en: https://scielo.isciii.es/pdf/cmf/v21n1-2/original5.pdf
15. Third World Health Organization (WHO) Global Consultation on Organ Donation and Transplantation: Striving to Achieve Self-Sufficiency was held in Madrid, Spain, on March 23-25, 2010). Disponible en: https://www.edqm.eu/sites/default/files/3rd_who_global_consultation_striving_to_achieve_self_sufficiency_2011.pdf
16. WHO. OMS. Principios rectores de la OMS sobre trasplante de células, tejidos yórganos humanos. Disponible en: https://www.who.int/transplantation/Guiding PrinciplesTransplantation WHA63.22sp.pdf

Resolución 327/2023
RESFC-2023-327-APN-D#INCUCAI
Ciudad de Buenos Aires, 25/09/2023
VISTO el EX-2023-01858161-APN-DM#INCUCAI, las disposiciones de la Ley Nº 27.447 de Trasplante de Órganos, Tejidos y Células, y su reglamentación aprobada por Decreto N° 16/2019 del Poder Ejecutivo Nacional; y
CONSIDERANDO
Que la Ley N° 27.447 tiene por objeto regular las actividades vinculadas a la obtención y utilización de órganos, tejidos y células de origen humano en todo el territorio de la República Argentina, incluyendo la investigación, promoción, donación, extracción, preparación, distribución, el trasplante y su seguimiento.
Que el INSTITUTO NACIONAL CENTRAL ÚNICO COORDINADOR DE ABLACIÓN E IMPLANTE (INCUCAI), en virtud de lo dispuesto en el artículo 3 del Decreto N° 16/2019 es la autoridad de aplicación del cuerpo legal citado precedentemente.
Que el artículo 39 de la Ley N° 27.447 establece que todo médico que certifique el fallecimiento de una persona debe iniciar el proceso de donación, conforme las normas que a dichos fines dicte el INCUCAI.
Que, respecto del fallecimiento, el artículo 36 ordena que el mismo puede certificarse tras el cese irreversible de las funciones circulatorias o de las funciones encefálicas, y que ambos se deben reconocer mediante un examen clínico adecuado tras un período apropiado de observación.
Que, asimismo, entre las responsabilidades que la Ley N° 27.447 le asigna al INCUCAI se encuentran las de dictar las normas técnicas a que deberá responder la obtención y utilización de órganos, tejidos y células para trasplante; como así también, aquellas relativas a la detección, selección y mantenimiento de potenciales donantes fallecidos, ablación, acondicionamiento y transporte.
Que merece destacarse, además, la competencia de este Organismo Nacional para entender en las actividades dirigidas al tratamiento de potenciales donantes fallecidos y en supervisar la correcta determinación del diagnóstico de muerte, ablación y acondicionamiento de los órganos, coordinando su acción con los Organismos Provinciales de Ablación e Implante (OPAI).
Que, en nuestro país, la donación de órganos para trasplante se realiza a partir de donantes fallecidos en unidades de terapia intensiva (UTI) a consecuencia de lesiones encefálicas catastróficas, con sostén artificial de funciones cardio respiratorias, es decir en muerte encefálica.
Que, sin embargo, el avance tecnológico generó la posibilidad de obtener órganos para trasplante de donantes cuyo fallecimiento se produjo por el cese irreversible de las funciones circulatorias, lo que se conoce como donación en asistolia, la cual ha sido categorizada en distintas modalidades o tipos, acorde al lugar y las circunstancias en las que se produjo el fallecimiento del paciente.
Que la posibilidad de donación de órganos, tanto después de la certificación de la muerte por el cese irreversible de las funciones encefálicas como de las circulatorias, requiere de requisitos y protocolos que normatizan las actividades dentro del marco legal vigente en cada país.
Que, en atención a ello, la Dirección Médica del INCUCAI ha elaborado el PROTOCOLO DE DONACIÓN EN ASISTOLIA con la finalidad de implementar y normatizar en nuestro país el proceso de extracción de órganos luego del fallecimiento de una persona, certificado mediante la determinación del cese irreversible de la función circulatoria.
Que dicho PROTOCOLO contempla la intervención y roles de los distintos actores del sistema de salud y del hospital que participan del proceso de donación en asistolia, como así también la descripción de los pasos ordenados y sucesivos que deben cumplir para llevar adelante el mismo.
Que en la propuesta se incluyeron las recomendaciones de las GUÍAS CLÍNICAS PARA LA CERTIFICACIÓN DE MUERTE EN PARO CIRCULATORIO y las recomendaciones en caso de no reanimación emitidas por la ORGANIZACIÓN MUNDIAL DE LA SALUD en el año 2014.
Que en la elaboración del PROTOCOLO participaron la SOCIEDAD ARGENTINA DE TRASPLANTE (SAT), la SOCIEDAD ARGENTINA DE TERAPIA INTENSIVA (SATI), y las COMISIONES ASESORAS DE TRASPLANTE RENAL Y TRASPLANTE HEPÁTICO del INCUCAI, efectuando cada una sus aportes en el ámbito de sus respectivas incumbencias.
Que, asimismo, el COMITÉ DE BIOÉTICA del INCUCAI tomo la intervención de su competencia sin objeciones que formular al respecto.
Que la COMISIÓN FEDERAL DE TRASPLANTES (COFETRA) ha brindado el asesoramiento previsto en el artículo 61 de la Ley N° 27.447, en la reunión llevada a cabo el día 13 de junio de 2022.
Que la DIRECCIÓN MÉDICA, la DIRECCIÓN CIENTÍFICO TÉCNICA y la DIRECCIÓN DE TECNOLOGÍAS Y SISTEMAS DE LA INFORMACIÓN han trabajado en la elaboración e implementación del protocolo propuesto y brindado sus informes técnicos pertinentes.
Que la DIRECCIÓN DE ASUNTOS JURÍDICOS del INCUCAI ha tomado la intervención de su competencia.
Que se actúa en uso de las facultades previstas por la Ley Nº 27.447, artículos 36, 39, 57 apartados 4, 13 y 19, y el artículo 3º del Decreto Nº 16/2019.
Que la medida que se adopta fue tratada en reunión de Directorio de fecha 25 de Septiembre de 2023, conforme surge del texto del Acta N° 30.
Por ello;
EL DIRECTORIO DEL INSTITUTO NACIONAL CENTRAL ÚNICO COORDINADOR DE ABLACIÓN E IMPLANTE
RESUELVE:
ARTÍCULO 1°.- Apruébese el PROTOCOLO DE DONACIÓN EN ASISTOLIA destinado a la obtención de órganos de personas fallecidas, cuya certificación se realiza mediante la determinación del cese irreversible de las funciones circulatorias, conforme a los fundamentos, actores intervinientes y algoritmo del proceso que se encuentran establecidos en el ANEXO I (IF- 2023-111890041-APN-DM#INCUCAI), que forma parte integrante de la presente resolución.
ARTICULO 2°.- Apruébese la GESTIÓN DE LISTA DE ESPERA – DISTRIBUCIÓN RENAL DEL DONANTE EN ASISTOLIA, de acuerdo a los criterios dispuestos en el ANEXO II (IF-2023-112558331-APN-DCT#INCUCAI) que también integra la presente.
ARTÍCULO 3°.- Las disposiciones establecidas en la presente resolución entrarán en vigencia el 2 de octubre de 2023.
ARTÍCULO 4°.- Regístrese, comuníquese. Dése a la DIRECCIÓN NACIONAL DEL REGISTRO OFICIAL para su publicación y archívese.
Richard Malan - Carlos Soratti
NOTA: El/los Anexo/s que integra/n este(a) Resolución se publican en la edición web del BORA -www.boletinoficial.gob.ar-
e. 26/09/2023 N° 77341/23 v. 26/09/2023
(Nota Infoleg: Los anexos referenciados en la presente norma han sido extraídos de la edición web de Boletín Oficial)
PROTOCOLO DE DONACIÓN EN ASISTOLIA
A.- INTRODUCCIÓN
La obtención de órganos para trasplante, en sus inicios, se realizó a partir de donantes fallecidos en unidades de terapia intensiva (UTI) a consecuencia de lesiones encefálicas catastróficas, con sostén artificial de funciones cardiorrespiratorias, es decir en muerte encefálica. Sin embargo, el avance tecnológico generó la posibilidad de obtener órganos para trasplante de donantes cuyo fallecimiento se produjo por el cese irreversible de las funciones circulatorias, lo que se conoce como donación en asistolia. En nuestro país, la Ley N° 27.447 de Trasplante de Órganos, Tejidos y Células ha incluido en el artículo 36 la certificación de muerte mediante la determinación del cese irreversible de las funciones circulatorias o del cese irreversible de las funciones encefálicas, según sea el caso.
Estas denominaciones quedaron plasmadas en la clasificación internacional como DBD (Donation after Brain Death) donación después de muerte encefálica, y DCD (Donation after Circulatory Death) donación después de muerte circulatoria.
La donación de órganos en asistolia (DCD) ha sido categorizada en distintas modalidades o tipos, acorde al lugar y las circunstancias en las que se produjo el fallecimiento del paciente.
La primera clasificación surgió en 1995 en la conferencia internacional Non Heart Beating Donation Conference, que tuvo lugar en la ciudad holandesa de Maastricht, generando cuatro (4) tipos de donantes en asistolia:
■ Tipo I: ingresa fallecido al hospital (incluye pacientes con muerte súbita, traumática o no, acontecida fuera del hospital que, por razones obvias, son trasladados a dicho establecimiento sin medidas de resucitación).
■ Tipo II: fallecido luego de reanimación cardio pulmonar (RCP) infructuosa.
■ Tipo III: fallecido en UTI incluye aquellos pacientes en los que se ha tomado la decisión de retiro de las medidas de soporte vital - adecuación de esfuerzo terapéutico (AET).
■ Tipo IV: pacientes que evolucionan al paro cardíaco en el proceso de diagnóstico de muerte encefálica.
■ Tipo II: fallecido luego de reanimación cardio pulmonar (RCP) infructuosa.
■ Tipo III: fallecido en UTI incluye aquellos pacientes en los que se ha tomado la decisión de retiro de las medidas de soporte vital - adecuación de esfuerzo terapéutico (AET).
■ Tipo IV: pacientes que evolucionan al paro cardíaco en el proceso de diagnóstico de muerte encefálica.
Esta clasificación original de Maastricht fue modificada en el año 2011 en Madrid, con el objetivo de incluir el término de donación en asistolia controlada o no controlada, dependiendo del momento y previsibilidad del fallecimiento en parada cardiocirculatoria. Se incluye a continuación el cuadro actualizado:
Se debe remarcar que la posibilidad de donación de órganos, tanto en DBD como en DCD, requiere de requisitos y protocolos que normatizan la actividad dentro del marco médico legal vigente en cada país y en el mundo.
En cuanto a la donación en asistolia, y tal como se ha señalado precedentemente, los países pioneros en su implementación han puesto en vigencia protocolos específicos que fueron utilizados y adecuados a cada realidad sanitaria. En lo que respecta particularmente al protocolo de donantes en asistolia controlada, conocido por sus siglas cDCD, hace referencia a la posibilidad de obtención de órganos de pacientes en los que se ha decidido el retiro de las medidas de soporte vital -adecuación del esfuerzo terapéutico (AET), es el denominado Tipo III de la clasificación de Maastricht. La toma de decisiones de adecuación terapéutica con retiro del soporte vital es, y debe ser, un proceso efectuado con carácter previo y completamente independiente de la posibilidad de donación de órganos posterior al fallecimiento. Dicho proceso es competencia pura y exclusiva del equipo de terapia intensiva en conjunto con las decisiones del paciente, o la subrogación de estas por parte de la familia, y se realiza en caso de padecer una enfermedad irreversible, incurable, o cuando se encuentre en estado terminal, o haya sufrido lesiones que lo coloquen en igual situación (art.59 inc.g Código Civil y Comericial de la Nación).
En la mayoría de los casos la posibilidad de donación de órganos luego de la parada circulatoria irreversible, en asistolia controlada, se concreta en pacientes con lesión cerebral gravísima, en coma profundo, que no cumplen los criterios de muerte encefálica, o en aquellos con otras patologías severas irrecuperables en los cuales los tratamientos son fútiles y, por ello, el equipo de salud plantea la posibilidad de adecuación de esfuerzo terapéutico y retiro del soporte vital.
En síntesis, la donación en asistolia es el proceso de extracción de órganos realizado luego del fallecimiento de una persona y certificado mediante la determinación del cese irreversible de la función circulatoria (art.36 Ley N° 27.447).
B.- DONACIÓN EN ASISTOLIA CONTROLADA (cDCD o Donación Maastricht III)
El presente protocolo tiene por objetivo normatizar la donación de órganos en asistolia, específicamente la denominada Asistolia Controlada o Tipo III de Maastricht y se circunscribirá en una primera etapa a la ablación de órganos abdominales. Para ello, se incluirá una descripción de los actores y el algoritmo del proceso.
I.- ACTORES DEL SISTEMA DE SALUD QUE PARTICIPAN DEL PROCESO Y ROLES
En el proceso de donación en asistolia controlada intervienen diferentes actores del sistema de salud y del hospital, cada uno de ellos con roles específicos. Se describen a continuación:
1. Equipo tratante del paciente (potencial donante): es el equipo de salud (médicos, enfermeros, kinesiólogos) responsable del control, seguimiento y tratamiento del paciente, proporcionándole todos los cuidados e intervenciones hasta su muerte, incluyendo el procedimiento de abstención o retiro del soporte vital por adecuación terapéutica. Realizará la certificación del fallecimiento mediante la determinación del cese irreversible de las funciones cardiocirculatorias, declarando la muerte cuando esta ocurra.
Es recomendable que, en caso de que se considere la donación de órganos post mortem, el retiro del soporte vital se realice en el quirófano, por lo tanto, este equipo será quien deba trasladar al paciente desde el lugar de internación, para luego realizar el procedimiento y permanecer junto a él hasta la declaración de muerte. De no ocurrir el deceso en el tiempo estipulado que permita la donación de órganos, seguirá a cargo del cuidado del paciente en un espacio apto continuando con las medidas de confort adecuadas al cuidado del final de la vida. Todo el proceso deberá quedar documentado en la historia clínica del paciente con el correspondiente consentimiento informado.
2. Equipo de ablación: es el equipo responsable de realizar la extracción de órganos sólidos y tejidos (cirujanos, instrumentadores y circulantes). El o los equipos de ablación podrán estar presentes en el quirófano antes del retiro del soporte vital con el único objetivo de preparar el campo quirúrgico (embrocado y colocación de campos estériles), la mesa de instrumental y los líquidos de preservación.
Una vez finalizada esta tarea, deben retirarse del quirófano a un espacio contiguo durante el retiro del soporte vital y la declaración de fallecimiento del paciente, volviendo a ingresar para iniciar la cirugía de ablación de órganos y tejidos una vez que el equipo tratante haya certificado la muerte del paciente.
3. Equipo de procuración: son los profesionales responsables de coordinar la procuración de órganos y tejidos, pudiendo pertenecer al staff de la Unidad Hospitalaria de Procuración -coordinador hospitalario de trasplante CHTX- o del Organismo Provincial de Ablación e Implante (OPAI). Podrán estar presentes en el proceso de retiro de soporte vital, con el único propósito de registrar los parámetros hemodinámicos y signos vitales, dado que serán relevantes para la posterior distribución y asignación de los órganos y/o tejidos donados. Este equipo no debe tener participación en la fase de retiro del soporte vital ni en la declaración de muerte del paciente.
El registro de los parámetros hemodinámicos se deberá asentar en la planilla de Registro de Parámetros Hemodinámicos, que forma parte del presente protocolo.
Es recomendable que, en caso de que se considere la donación de órganos post mortem, el retiro del soporte vital se realice en el quirófano, por lo tanto, este equipo será quien deba trasladar al paciente desde el lugar de internación, para luego realizar el procedimiento y permanecer junto a él hasta la declaración de muerte. De no ocurrir el deceso en el tiempo estipulado que permita la donación de órganos, seguirá a cargo del cuidado del paciente en un espacio apto continuando con las medidas de confort adecuadas al cuidado del final de la vida. Todo el proceso deberá quedar documentado en la historia clínica del paciente con el correspondiente consentimiento informado.
2. Equipo de ablación: es el equipo responsable de realizar la extracción de órganos sólidos y tejidos (cirujanos, instrumentadores y circulantes). El o los equipos de ablación podrán estar presentes en el quirófano antes del retiro del soporte vital con el único objetivo de preparar el campo quirúrgico (embrocado y colocación de campos estériles), la mesa de instrumental y los líquidos de preservación.
Una vez finalizada esta tarea, deben retirarse del quirófano a un espacio contiguo durante el retiro del soporte vital y la declaración de fallecimiento del paciente, volviendo a ingresar para iniciar la cirugía de ablación de órganos y tejidos una vez que el equipo tratante haya certificado la muerte del paciente.
3. Equipo de procuración: son los profesionales responsables de coordinar la procuración de órganos y tejidos, pudiendo pertenecer al staff de la Unidad Hospitalaria de Procuración -coordinador hospitalario de trasplante CHTX- o del Organismo Provincial de Ablación e Implante (OPAI). Podrán estar presentes en el proceso de retiro de soporte vital, con el único propósito de registrar los parámetros hemodinámicos y signos vitales, dado que serán relevantes para la posterior distribución y asignación de los órganos y/o tejidos donados. Este equipo no debe tener participación en la fase de retiro del soporte vital ni en la declaración de muerte del paciente.
El registro de los parámetros hemodinámicos se deberá asentar en la planilla de Registro de Parámetros Hemodinámicos, que forma parte del presente protocolo.
II. - ALGORITMO DEL PROCESO DE DONACIÓN EN ASISTOLIA CONTROLADA (cDCD)
En este apartado se describen todos los pasos ordenados y sucesivos del proceso de donación en asistolia controlada.
II.1. MANEJO EN UNIDAD DE TERAPIA INTENSIVA
1. El proceso de toma de decisiones para el retiro del soporte vital por adecuación terapéutica -AET- debe haberse concretado con carácter previo e independientemente de la posibilidad de la donación de órganos. Deberá encontrarse legitimado en el correspondiente documento de Consentimiento Informado, acorde a lo previsto en los artículos 2 y 5 de la Ley N° 26.529 de Derechos del Paciente (texto actualizado Ley N° 26.742) y su Decreto Reglamentario N° 1089/2012 y en el artículo 59 del Código Civil y Comercial de la Nación.
2. Una vez cumplimentado el paso anterior, el equipo médico tratante de la unidad de terapia intensiva (UTI) deberá comunicar dicha decisión al equipo de procuración, a fin de que este evalúe la posibilidad de iniciar el proceso de donación de órganos.
3. El equipo de procuración se dirigirá a la UTI y, en primera instancia, deberá constatar en la historia clínica el documento de Consentimiento Informado mencionado en el punto 1. Una vez efectuada dicha constatación, podrá evaluar la posibilidad y viabilidad de la donación de órganos y tejidos luego de que se produzca el fallecimiento. En caso de que ello sea posible, deberá iniciar el proceso de donación conforme a lo establecido en la Ley N° 27.447 y su Decreto Reglamentario N° 16/2019, artículos 31, 32, 33 y concordantes de dicha legislación, y el Protocolo de Actuación aprobado por Resolución INCUCAI N° 54/2018.
4. En dicho marco se deberá informar a la familia, resguardando los aspectos ético-legales que requiere dicho proceso. En este caso, de donación de órganos en asistolia controlada, la información deberá brindarse con antelación al retiro del soporte vital y certificación del fallecimiento, incluyendo los procedimientos específicos invasivos o no invasivos sobre el paciente, o de la administración de fármacos que pudiesen requerirse previo al retiro del soporte vital con el objetivo de evaluar y/o mantener la viabilidad de los órganos. De todo lo actuado se deberá dejar constancia en la historia clínica y, en caso de corresponder, en el debido consentimiento informado.
5. El equipo tratante de la UTI y el equipo de procuración deberán incluir información adicional acerca del curso a seguir en caso de que, luego del retiro de las medidas de soporte vital, no se produjese el paro circulatorio irreversible en el lapso que permitiese la donación de órganos viables para trasplante.
6. En el caso de que ocurriese la situación descripta en el punto anterior, el control, seguimiento y tratamiento del paciente seguirá siendo responsabilidad del equipo profesional de la UTI hasta que se concluya con el proceso de retiro de soporte vital y se realice la certificación del fallecimiento mediante la determinación del cese irreversible de las funciones cardiocirculatorias, tarea que es competencia del propio equipo de UTI.
2. Una vez cumplimentado el paso anterior, el equipo médico tratante de la unidad de terapia intensiva (UTI) deberá comunicar dicha decisión al equipo de procuración, a fin de que este evalúe la posibilidad de iniciar el proceso de donación de órganos.
3. El equipo de procuración se dirigirá a la UTI y, en primera instancia, deberá constatar en la historia clínica el documento de Consentimiento Informado mencionado en el punto 1. Una vez efectuada dicha constatación, podrá evaluar la posibilidad y viabilidad de la donación de órganos y tejidos luego de que se produzca el fallecimiento. En caso de que ello sea posible, deberá iniciar el proceso de donación conforme a lo establecido en la Ley N° 27.447 y su Decreto Reglamentario N° 16/2019, artículos 31, 32, 33 y concordantes de dicha legislación, y el Protocolo de Actuación aprobado por Resolución INCUCAI N° 54/2018.
4. En dicho marco se deberá informar a la familia, resguardando los aspectos ético-legales que requiere dicho proceso. En este caso, de donación de órganos en asistolia controlada, la información deberá brindarse con antelación al retiro del soporte vital y certificación del fallecimiento, incluyendo los procedimientos específicos invasivos o no invasivos sobre el paciente, o de la administración de fármacos que pudiesen requerirse previo al retiro del soporte vital con el objetivo de evaluar y/o mantener la viabilidad de los órganos. De todo lo actuado se deberá dejar constancia en la historia clínica y, en caso de corresponder, en el debido consentimiento informado.
5. El equipo tratante de la UTI y el equipo de procuración deberán incluir información adicional acerca del curso a seguir en caso de que, luego del retiro de las medidas de soporte vital, no se produjese el paro circulatorio irreversible en el lapso que permitiese la donación de órganos viables para trasplante.
6. En el caso de que ocurriese la situación descripta en el punto anterior, el control, seguimiento y tratamiento del paciente seguirá siendo responsabilidad del equipo profesional de la UTI hasta que se concluya con el proceso de retiro de soporte vital y se realice la certificación del fallecimiento mediante la determinación del cese irreversible de las funciones cardiocirculatorias, tarea que es competencia del propio equipo de UTI.
II.2. -TRASLADO A QUIRÓFANO
II.3. - MANEJO EN EL QUIRÓFANO Y PREPARACIÓN DEL CAMPO QUIRÚRGICO
1. El paciente al que se le retirará el soporte vital y que será un posible donante en asistolia controlada deberá ser trasladado a quirófano para efectuar dicho procedimiento de retiro ventilatorio y vascular, debiendo estar acompañado por el equipo tratante (médico de UTI), responsable de efectuarlo, como así también de certificar la muerte cuando esta ocurra.
2. Previo al traslado el paciente, se deberá constatar que el mismo tenga colocada una vía arterial funcionante para monitoreo de parámetros hemodinámicos (tensión arterial (TA) y pulso).
2. Previo al traslado el paciente, se deberá constatar que el mismo tenga colocada una vía arterial funcionante para monitoreo de parámetros hemodinámicos (tensión arterial (TA) y pulso).
II.3. - MANEJO EN EL QUIRÓFANO Y PREPARACIÓN DEL CAMPO QUIRÚRGICO
1. Se colocará al paciente en la mesa de operaciones, donde el equipo tratante lo conectará al respirador y al monitor de la mesa de anestesia.
2. El equipo de ablación (cirujanos, instrumentadores y circulantes) ingresará a quirófano previo al inicio del proceso de retiro del soporte vital, con el único objetivo de preparar el campo operatorio y el instrumental quirúrgico. Los cirujanos y el instrumentador deberán realizar el lavado correspondiente para garantizar la asepsia. Luego de ello, efectuarán el embrocado, la colocación de campos quirúrgicos, la preparación de la mesa desplegada con el instrumental quirúrgico y las soluciones de preservación colgadas con sus respectivas cánulas. Una vez concluida esta preparación, el equipo de ablación debe retirarse del quirófano (manteniendo camisolín y guantes estériles).
3. El equipo de ablación (cirujanos, instrumentadores y circulantes) no debe estar presente en el quirófano durante el retiro del soporte ventilatorio y circulatorio y la certificación del fallecimiento. Deberá mantenerse fuera del quirófano, ubicándose en un cuarto contiguo al mismo, durante un lapso que va desde el inicio del proceso de retiro del soporte vital hasta la finalización completa de la certificación del fallecimiento del paciente por parte del equipo tratante.
4. El equipo de procuración podrá estar presente durante el retiro del soporte vital con el único objetivo de documentar los parámetros requeridos a posteriori para la distribución de órganos. No tendrá ninguna participación en el proceso de retiro del soporte vital y certificación del fallecimiento. Deberá registrar los siguientes parámetros: hemodinámicos, hora del retiro del soporte vital, hora del cese de la función cardiorrespiratoria, hora de la declaración de muerte, hora de la incisión quirúrgica y hora del comienzo de la perfusión con solución de preservación, en la planilla de Registro de Parámetros Hemodinámicos.
2. El equipo de ablación (cirujanos, instrumentadores y circulantes) ingresará a quirófano previo al inicio del proceso de retiro del soporte vital, con el único objetivo de preparar el campo operatorio y el instrumental quirúrgico. Los cirujanos y el instrumentador deberán realizar el lavado correspondiente para garantizar la asepsia. Luego de ello, efectuarán el embrocado, la colocación de campos quirúrgicos, la preparación de la mesa desplegada con el instrumental quirúrgico y las soluciones de preservación colgadas con sus respectivas cánulas. Una vez concluida esta preparación, el equipo de ablación debe retirarse del quirófano (manteniendo camisolín y guantes estériles).
3. El equipo de ablación (cirujanos, instrumentadores y circulantes) no debe estar presente en el quirófano durante el retiro del soporte ventilatorio y circulatorio y la certificación del fallecimiento. Deberá mantenerse fuera del quirófano, ubicándose en un cuarto contiguo al mismo, durante un lapso que va desde el inicio del proceso de retiro del soporte vital hasta la finalización completa de la certificación del fallecimiento del paciente por parte del equipo tratante.
4. El equipo de procuración podrá estar presente durante el retiro del soporte vital con el único objetivo de documentar los parámetros requeridos a posteriori para la distribución de órganos. No tendrá ninguna participación en el proceso de retiro del soporte vital y certificación del fallecimiento. Deberá registrar los siguientes parámetros: hemodinámicos, hora del retiro del soporte vital, hora del cese de la función cardiorrespiratoria, hora de la declaración de muerte, hora de la incisión quirúrgica y hora del comienzo de la perfusión con solución de preservación, en la planilla de Registro de Parámetros Hemodinámicos.
11.4. - SEDACIÓN Y ANALGESIA
El protocolo de adecuación del esfuerzo terapéutico del centro en que se encuentra internado el paciente debe contemplar la sedación y analgesia que se administrará en esta situación. No obstante, se recomienda que se utilicen benzodiacepinas (midazolam, lorazepam, diazepam) como sedantes y opiáceos (morfina, fentanilo, remifentanilo) como analgésicos. La combinación que se elija debe utilizarse en dosis terapéuticas máximas. También puede utilizarse propofol en caso de estar disponible ya que combina propiedades sedantes y analgésicas.
La administración de las drogas debe ser parenteral por el acceso venoso disponible, en lo posible a través de bombas de infusión continua. En caso de no haberse iniciado previamente, la infusión debe comenzar al momento de la implementación de la adecuación terapéutica y debe permanecer hasta tanto finalice el período de observación en el quirófano. En caso de que no se produjera la parada cardíaca y el paciente regrese al sector de internación se continuará con la infusión a menos que el protocolo de adecuación terapéutica indique lo contrario.
Cabe aclarar que si el paciente ha recibido este tipo de drogas por muchos días es posible que haya desarrollado tolerancia y que las dosis requeridas sean mayores al estándar. Esta situación debe ser valorada por el médico intensivista encargado de la extubación, y es este profesional quien adecuará la dosis infundida según su criterio profesional.
El protocolo de adecuación del esfuerzo terapéutico del centro en que se encuentra internado el paciente debe contemplar la sedación y analgesia que se administrará en esta situación. No obstante, se recomienda que se utilicen benzodiacepinas (midazolam, lorazepam, diazepam) como sedantes y opiáceos (morfina, fentanilo, remifentanilo) como analgésicos. La combinación que se elija debe utilizarse en dosis terapéuticas máximas. También puede utilizarse propofol en caso de estar disponible ya que combina propiedades sedantes y analgésicas.
La administración de las drogas debe ser parenteral por el acceso venoso disponible, en lo posible a través de bombas de infusión continua. En caso de no haberse iniciado previamente, la infusión debe comenzar al momento de la implementación de la adecuación terapéutica y debe permanecer hasta tanto finalice el período de observación en el quirófano. En caso de que no se produjera la parada cardíaca y el paciente regrese al sector de internación se continuará con la infusión a menos que el protocolo de adecuación terapéutica indique lo contrario.
Cabe aclarar que si el paciente ha recibido este tipo de drogas por muchos días es posible que haya desarrollado tolerancia y que las dosis requeridas sean mayores al estándar. Esta situación debe ser valorada por el médico intensivista encargado de la extubación, y es este profesional quien adecuará la dosis infundida según su criterio profesional.
11.5. - RETIRO DEL SOPORTE VITAL
1. El equipo tratante del paciente, es el responsable de realizar el procedimiento de retiro del soporte vital. El mismo consiste en desconectar al paciente del respirador y apagar la bomba de infusión de drogas vasoactivas.
2. Al mismo equipo médico tratante de la UTI es al que le corresponderá efectuar el monitoreo del paciente y registrar el momento preciso en que se produce el cese de la función cardiocirculatoria - paro cardiocirculatorio-. El parámetro para proceder a dicho registro es el de presión de pulso igual a cero (0), la que se determinará utilizando el catéter arterial colocado en el paciente. Una vez registrado dicho momento del paro cardiocirculatorio, procederá a certificar el fallecimiento mediante la determinación del cese irreversible de las funciones circulatorias, cumplimentando los requisitos exigidos para ello, enumerados en el apartado específico - II. 6 Certificación del fallecimiento - del presente protocolo.
3. En el caso de que el paro cardiocirculatorio no se produjese luego del retiro de las medidas de soporte vital -AET- y, transcurridos los tiempos de espera que excluyen la viabilidad y posibilidad de la donación de órganos, el paciente deberá ser trasladado a un lugar destinado especialmente para proveer las correspondientes medidas de confort del final de la vida.
2. Al mismo equipo médico tratante de la UTI es al que le corresponderá efectuar el monitoreo del paciente y registrar el momento preciso en que se produce el cese de la función cardiocirculatoria - paro cardiocirculatorio-. El parámetro para proceder a dicho registro es el de presión de pulso igual a cero (0), la que se determinará utilizando el catéter arterial colocado en el paciente. Una vez registrado dicho momento del paro cardiocirculatorio, procederá a certificar el fallecimiento mediante la determinación del cese irreversible de las funciones circulatorias, cumplimentando los requisitos exigidos para ello, enumerados en el apartado específico - II. 6 Certificación del fallecimiento - del presente protocolo.
3. En el caso de que el paro cardiocirculatorio no se produjese luego del retiro de las medidas de soporte vital -AET- y, transcurridos los tiempos de espera que excluyen la viabilidad y posibilidad de la donación de órganos, el paciente deberá ser trasladado a un lugar destinado especialmente para proveer las correspondientes medidas de confort del final de la vida.
II.6). - CERTIFICACIÓN DEL FALLECIMIENTO
En virtud de lo establecido en el artículo 36 de la Ley N° 27.447 y de conformidad a lo establecido por la ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS), la certificación del fallecimiento mediante el cese irreversible de las funciones circulatorias se determinará mediante la constatación de los siguientes signos:
1) Ausencia de pulso central mediante palpación
2) Ausencia de sonidos cardíacos en la auscultación
3) Ausencia de respiración
4) Ausencia de respuesta pupilar a la luz.
5) En el contexto de la abstención o retiro de las medidas de soporte vital -AET-, para la certificación del fallecimiento se deberá efectuar, al menos una, de las siguientes pruebas instrumentales:
En virtud de lo establecido en el artículo 36 de la Ley N° 27.447 y de conformidad a lo establecido por la ORGANIZACIÓN MUNDIAL DE LA SALUD (OMS), la certificación del fallecimiento mediante el cese irreversible de las funciones circulatorias se determinará mediante la constatación de los siguientes signos:
1) Ausencia de pulso central mediante palpación
2) Ausencia de sonidos cardíacos en la auscultación
3) Ausencia de respiración
4) Ausencia de respuesta pupilar a la luz.
5) En el contexto de la abstención o retiro de las medidas de soporte vital -AET-, para la certificación del fallecimiento se deberá efectuar, al menos una, de las siguientes pruebas instrumentales:
a) Asistolia o ausencia de actividad eléctrica pulsátil por electrocardiograma ECG y/o
b) Ausencia de onda pulsátil por monitoreo de presión intraarterial y/o
c) Ausencia de actividad contráctil cardíaca por Ecocardiograma
b) Ausencia de onda pulsátil por monitoreo de presión intraarterial y/o
c) Ausencia de actividad contráctil cardíaca por Ecocardiograma
Período de Observación: Una vez que se haya concluido con al menos una de las pruebas instrumentales enumeradas en el apartado 5 y si el resultado de estas confirma el cese de la función circulatoria, se exige un tiempo de espera de al menos 5 minutos, para asegurar la irreversibilidad de esta. El fallecimiento será declarado una vez que haya transcurrido dicho período de observación.
II.7. - ABLACIÓN Y TIEMPOS DE ISQUEMIA
Se reitera que el proceso de ablación podrá iniciarse una vez que ha concluido la certificación del fallecimiento.
Se incluye a continuación la descripción de las técnicas a utilizar y los tiempos de isquemia recomendados para órganos intraabdominales.
Se reitera que el proceso de ablación podrá iniciarse una vez que ha concluido la certificación del fallecimiento.
1. Una vez concluida la certificación de muerte, se avisará al equipo de ablación para su ingreso al quirófano a fin de iniciar la ablación de órganos.
2. El inicio de la cirugía de ablación se deberá ejecutar en forma expedita a fin de minimizar el tiempo de isquemia de los órganos.
2. El inicio de la cirugía de ablación se deberá ejecutar en forma expedita a fin de minimizar el tiempo de isquemia de los órganos.
Se incluye a continuación la descripción de las técnicas a utilizar y los tiempos de isquemia recomendados para órganos intraabdominales.
II.7.a). - Ablación de órganos abdominales (riñón e hígado y páncreas)
1. El inicio de la cirugía de ablación se debe ejecutar en forma expedita mediante la realización de una incisión mediana infraumbilical y canulación de la aorta para iniciar la perfusión de los órganos y colocación de hielo en toda la cavidad. Esta técnica se denomina super rápida.
2. Posteriormente se procede a realizar el clampeo en aorta torácica previa realización de esternotomía (opcionalmente se puede clampear en aorta supra celíaca). El venteo de la vena cava se realiza en aurícula derecha. El venteo de la cava debe realizarse primero si el clampeo de la aorta no se efectúa de modo inmediato, ello evitará el edema de los órganos.
3. Si se va a ablacionar hígado y es de preferencia del equipo se puede canular la vena mesentérica inferior o alternativamente la vena porta puede ser perfundida en back table.
4. Se procede a la extracción de los órganos. En caso de ablacionar hígado sin páncreas se recomienda hacerlo con la cabeza pancreática para evitar secciones de una posible arteria hepática derecha reemplazada o accesoria ya que los pulsos no pueden ser evaluados en este tipo de donantes. En caso de ablación de hígado y páncreas se recomienda hacerlo en bloque y separarlos en cirugía de banco. Los riñones se extraen de modo habitual en bloque y se dividen en cirugía de banco.
5. Una alternativa a la técnica super rápida que permite realizar la ablación sin el apuro inherente a dicha técnica es la canulación pre mortem de los vasos femorales previamente al retiro del soporte vital. Se debe obtener un consentimiento informado específico para realizar esta intervención sobre el paciente. Una vez declarada la muerte se comienza con la infusión de solución de preservación a través de la arteria femoral y se realiza el venteo a través de la vena. A continuación, se realiza la laparotomía y se coloca hielo. Luego se realiza el clampeo aórtico y la extracción de los órganos.
2. Posteriormente se procede a realizar el clampeo en aorta torácica previa realización de esternotomía (opcionalmente se puede clampear en aorta supra celíaca). El venteo de la vena cava se realiza en aurícula derecha. El venteo de la cava debe realizarse primero si el clampeo de la aorta no se efectúa de modo inmediato, ello evitará el edema de los órganos.
3. Si se va a ablacionar hígado y es de preferencia del equipo se puede canular la vena mesentérica inferior o alternativamente la vena porta puede ser perfundida en back table.
4. Se procede a la extracción de los órganos. En caso de ablacionar hígado sin páncreas se recomienda hacerlo con la cabeza pancreática para evitar secciones de una posible arteria hepática derecha reemplazada o accesoria ya que los pulsos no pueden ser evaluados en este tipo de donantes. En caso de ablación de hígado y páncreas se recomienda hacerlo en bloque y separarlos en cirugía de banco. Los riñones se extraen de modo habitual en bloque y se dividen en cirugía de banco.
5. Una alternativa a la técnica super rápida que permite realizar la ablación sin el apuro inherente a dicha técnica es la canulación pre mortem de los vasos femorales previamente al retiro del soporte vital. Se debe obtener un consentimiento informado específico para realizar esta intervención sobre el paciente. Una vez declarada la muerte se comienza con la infusión de solución de preservación a través de la arteria femoral y se realiza el venteo a través de la vena. A continuación, se realiza la laparotomía y se coloca hielo. Luego se realiza el clampeo aórtico y la extracción de los órganos.
II.7.b).- Tiempos de isquemia recomendados según órgano
Para el hígado, el tiempo de isquemia tibio verdadero (intervalo desde la caída de la MAP por debajo de 60 mmHg y el inicio de la perfusión) no debe ser mayor de 20-30 minutos y el tiempo de isquemia tibio total (intervalo desde el retiro del soporte vital y el inicio de la perfusión) no debe ser mayor de 30-45 minutos.
Para riñón, el tiempo de isquemia total no debe ser mayor a 45-60 minutos.
Para el hígado, el tiempo de isquemia tibio verdadero (intervalo desde la caída de la MAP por debajo de 60 mmHg y el inicio de la perfusión) no debe ser mayor de 20-30 minutos y el tiempo de isquemia tibio total (intervalo desde el retiro del soporte vital y el inicio de la perfusión) no debe ser mayor de 30-45 minutos.
Para riñón, el tiempo de isquemia total no debe ser mayor a 45-60 minutos.
II.8. - LÍNEA DE TIEMPO PROGRAMA DE ASISTOLIA CONTROLADA
PLANILLA N° 1.
MODELO DE REGISTRO DE PARÁMETROS HEMODINÁMICOS
BIBLIOGRAFIA
1. ASTS American Society of Transplant Surgeons. “Recommended Practice Guidelines for Controlled Donation after Cardiac Death Organ Procurement and Transplantation“. Am J Transplant. 2009 Sep;9(9):2004-11. doi: 10.1111/j.1600- 6143.2009.02739.x. Disponible en: https://pubmed.ncbi.nlm.nih.gov/19624569/
2. Australian Governmento Organ and Tissue Authority. National Protocol forDonation after Cardiac Death july 2010. Disponible en: https://www.donatelife.gov.au/sites/default/files/DCD%20protocol%20020311- 0e4e2c3d-2ef5-4dff- b7ef-af63d0bf6a8a-1.PDF.
3. Beatriz Dominguez-Gil , Nancy Ascher, Alexander M. Capron, Dale Gardiner, Alexander R. Manara, James L. Bernat, Eduardo Minambres, Jeffrey M. Singh, Robert J. Porte, James F. Markmann, Kumud Dhital, Didier Ledoux, Constantino Fondevila, Sarah Hosgood, Dirk Van Raemdonck, Shaf Keshavjee, James Dubois, Andrew McGee, Galen V. Henderson, Alexandra K. Glazier, Stefan G. Tullius , Sam D. Shemie and Francis L. Delmonico. “Expanding controlled donation after the circulatory determination of death: statement from an international collaborative”. Conference Reports and expert panel. Intensive CareMed https://doi.org/10.1007/s00134-020-06341-7
4. Council fo Europe. EDQM European Directorate for the quality of medicines & Health Care. Guía para la calidad y la seguridad de órganos para el trasplante. 2016
5. J L Bernat, A M D'Alessandro, F K Port, T P Bleck, S O Heard, J Medina, S H Rosenbaum, M A Devita, R S Gaston, R M Merion, M L Barr, W H Marks, H Nathan, K O'connor, D L Rudow, A B Leichtman, P Schwab, N L Ascher, R A Metzger, V Mc Bride, W Graham, D Wagner, J Warren, F L Delmonico. “Report of a National Conference on Donation after Cardiac Death AJT” 2006. Am J Transplant. 2006 Feb;6(2):281-91. doi: 10.1111/j.1600-6143.2005.01194.x.
6. Cleveland Clinic Organ, Tissue and Eye Donation After Determination ofCirculatory Death Procedure. Disponible en: https://my.clevelandclinic.org/ccf/media/files/Bioethics/Organ_procurement_poli cy.pdf
7. Código Civil y Comercial de la Nación. Ley Nacional N° 26994. http://servicios.infoleg.gob.ar/infolegInternet/anexos/235000- 239999/235975/norma.htm
8. Ley Nacional de Trasplante de órganos, tejidos y células, Ley Nacional N° 27447.Disponible en: /normativa/nacional/ley-27447-2018-312715
9. Ley Nacional de Derechos del paciente , Ley Nacional N° 26529. Disponible en: http://servicios.infoleg.gob.ar/infolegInternet/anexos/160000- 164999/160432/texact.htm
10. OMS.WHO. Clinical Criteria for the Determination of Death. WHO Technical Expert Consultation. WHO Headquarters, Geneva, Switezerland. 22.23 september 2014. Disponible en: https://apps.who.int/iris/handle/10665/254737 y completo para descarga en: https://apps.who.int/iris/bitstream/handle/10665/254737/WHO-HIS-SDS-2017.5-eng.pdf?sequence=1&isAllowed=y
11. ONT. Organización Nacional de Trasplante. Ministerio de Sanidad y Consumo de España. Donación en Asistolia en España: situación actual y recomendaciones. Documento de Consenso Nacional 2012. Disponible en: http://www.ont.es/infesp/DocumentosDeConsenso/DONACI%C3%93N%20EN%20ASISTOLIA%20ENo/o20ESPAo/oC3o/o91A.o/o20SITUACIo/oC3o/o93No/o20ACT UAL%20Y%20RECOMENDACIONES.pdf
12. AR Manara; PG. Murphy and G. O'Callaghan. Donation after circulatory death. British Journal of Anaesthesia 108 (S1): i108-i121 (2012). doi:10.1093/bja/aer357. Disponible en: https://www.who.int/servicedeliverysafety/ddcr84.pdf
13. Marie Thoung, Angel Ruiz, Patrick Evrard, Michael Kuiper, Catherine Boffa, Mohammed Akhtar, James Neuberger and Rutger Ploeg. Review. New classification of donation after circulatory death donors definitions and terminology. Transplant International. 016 Jul;29(7):749-59.doi: 10.1111/tri.12776. Epub 2016 May 4. Disponible en: https://pubmed.ncbi.nlm.nih.gov/26991858/
14. Perez Villares JM. Donación en asistolia Donation after circulatory determination of death. Cuad Med Forense 2015;21(1-2):43-49. Disponible en: https://scielo.isciii.es/pdf/cmf/v21n1-2/original5.pdf
15. Third World Health Organization (WHO) Global Consultation on Organ Donation and Transplantation: Striving to Achieve Self-Sufficiency was held in Madrid, Spain, on March 23-25, 2010). Disponible en: https://www.edqm.eu/sites/default/files/3rd_who_global_consultation_striving_to_achieve_self_sufficiency_2011.pdf
16. WHO. OMS. Principios rectores de la OMS sobre trasplante de células, tejidos yórganos humanos. Disponible en: https://www.who.int/transplantation/Guiding PrinciplesTransplantation WHA63.22sp.pdf
IF-2023-111890041-APN-DM#INCUCAI
GESTIÓN LISTA DE ESPERA DISTRIBUCIÓN RENAL DONANTE ASISTOLIA
1.- Estructuración de Lista de Espera
1.2.- Regionalidad: a los fines de la confección de listas de potenciales receptores para asignación de riñones provenientes de donantes en asistolia, se definen las regiones sanitarias de acuerdo con lo establecido en la Resolución INCUCAI N° 002/17, o la que en un futuro la modifique o reemplace.
1.3.- Categorías potenciales receptores
1.4.- Tiempo en diálisis: Los potenciales receptores que se encuentren bajo tratamiento dialítico se le otorgará puntaje adicional durante la distribución según lo especificado Resolución 341/2. ANEXO III punto 4.1. f). Los pacientes con tiempo en diálisis mayor o igual a 4 (cuatro) años se le otorgará 3 (tres) puntos extras al especificado en dicha resolución.
2.- Procedimiento durante la distribución lista de espera renal
2.1.- Apertura de lista de espera renal
La apertura de lista y asignación de órganos se deberá realizar previo a la suspensión del soporte artificial del potencial donante.
2.2.- Criterios de inclusión de Donantes:
Se procederá a asignación de receptores si el donante cumple con los siguientes requisitos:
2.3.- Exclusiones de receptores:
No serán incluidos en lista de distribución renal de órganos provenientes de donantes en asistolia aquellos potenciales receptores que presenten algunas de las siguientes condiciones:
2.3.- Aceptación del órgano:
2.4.- Ordenamiento en lista de distribución para trasplante renal:
La lista de distribución para trasplante renal se confeccionará según los siguientes criterios:

1.- Estructuración de Lista de Espera
1.2.- Regionalidad: a los fines de la confección de listas de potenciales receptores para asignación de riñones provenientes de donantes en asistolia, se definen las regiones sanitarias de acuerdo con lo establecido en la Resolución INCUCAI N° 002/17, o la que en un futuro la modifique o reemplace.
1. Lista Provincial: Se define como lista provincial a aquella conformada por los potenciales receptores con domicilio del equipo de trasplante en cada una de las veintitrés (23) provincias del país y Ciudad Autónoma de Buenos Aires, donde se efectuará la distribución de los órganos procurados en esa provincia de acuerdo al domicilio del establecimiento generador del donante.
2. Lista Regional: se define como lista regional a aquella conformada por los potenciales receptores con domicilio del equipo de trasplante en cada una de las seis (6) regiones establecidas, donde se efectúa la distribución de los órganos que no sean adjudicados en la provincia de la región.
3. Lista Nacional: se define como lista nacional a aquella conformada por todas las regiones del país, que se realiza la distribución de los órganos que no sean adjudicados en una provincia o región de generación del donante.
2. Lista Regional: se define como lista regional a aquella conformada por los potenciales receptores con domicilio del equipo de trasplante en cada una de las seis (6) regiones establecidas, donde se efectúa la distribución de los órganos que no sean adjudicados en la provincia de la región.
3. Lista Nacional: se define como lista nacional a aquella conformada por todas las regiones del país, que se realiza la distribución de los órganos que no sean adjudicados en una provincia o región de generación del donante.
1.3.- Categorías potenciales receptores
1. Receptor Pediátricos: se considera al potencial receptor con edad menor a 18 (dieciocho) años al momento de la apertura de lista de distribución, según lo definido en la Resolución 341/21. ANEXO III punto 4.1 d). Se incluirá en la lista de distribución renal de donante en asistolia aquellos pacientes mayores o igual a 14 (catorce) años al momento de la distribución.
2. Paciente cero Missmatch: Se considerará como tal cuando todos los antígenos de histocompatibilidad del donante, están presentes en la tipificación de antígenos de histocompatibilidad del potencial receptor.Obtendrá puntaje adicional según lo especificado en Resolución 341/21. ANEXO III punto 4.1 i.
3. Último Acceso Vascular: los potenciales receptores incorporados en dicha categoría según lo especificado en la Resolución 341/2. ANEXO IV. Tendrán prioridad luego de los Receptores Hipersensibilizados y cero Missmatch.
4. Receptor hipersensibilizado: se considera potencial receptor hipersensibilizado aquel que presente un Cross Match por método de fase sólida mayor o igual a 85% (ochenta y ciento). La distribución para los pacientes hipersensibilizados se realiza teniendo en cuenta Antígenos (Ag) HLA a evitar, excluyendo de la lista de distribución a los pacientes que se encuentren en esa condición respecto del donante. Tendrán prioridad sobre los pacientes “cero mismatch y “último acceso vascular'.
5. Receptor adulto mayor: se incluye en esta categoría los potenciales receptores que al momento de apertura de la lista de distribución presenten una edad igual o mayor a 60 años. Se le otorgará un puntaje adicional de 3 (tres) puntos al momento de la distribución.
2. Paciente cero Missmatch: Se considerará como tal cuando todos los antígenos de histocompatibilidad del donante, están presentes en la tipificación de antígenos de histocompatibilidad del potencial receptor.Obtendrá puntaje adicional según lo especificado en Resolución 341/21. ANEXO III punto 4.1 i.
3. Último Acceso Vascular: los potenciales receptores incorporados en dicha categoría según lo especificado en la Resolución 341/2. ANEXO IV. Tendrán prioridad luego de los Receptores Hipersensibilizados y cero Missmatch.
4. Receptor hipersensibilizado: se considera potencial receptor hipersensibilizado aquel que presente un Cross Match por método de fase sólida mayor o igual a 85% (ochenta y ciento). La distribución para los pacientes hipersensibilizados se realiza teniendo en cuenta Antígenos (Ag) HLA a evitar, excluyendo de la lista de distribución a los pacientes que se encuentren en esa condición respecto del donante. Tendrán prioridad sobre los pacientes “cero mismatch y “último acceso vascular'.
5. Receptor adulto mayor: se incluye en esta categoría los potenciales receptores que al momento de apertura de la lista de distribución presenten una edad igual o mayor a 60 años. Se le otorgará un puntaje adicional de 3 (tres) puntos al momento de la distribución.
1.4.- Tiempo en diálisis: Los potenciales receptores que se encuentren bajo tratamiento dialítico se le otorgará puntaje adicional durante la distribución según lo especificado Resolución 341/2. ANEXO III punto 4.1. f). Los pacientes con tiempo en diálisis mayor o igual a 4 (cuatro) años se le otorgará 3 (tres) puntos extras al especificado en dicha resolución.
2.- Procedimiento durante la distribución lista de espera renal
2.1.- Apertura de lista de espera renal
La apertura de lista y asignación de órganos se deberá realizar previo a la suspensión del soporte artificial del potencial donante.
2.2.- Criterios de inclusión de Donantes:
Se procederá a asignación de receptores si el donante cumple con los siguientes requisitos:
1. Edad menor o igual 65 años
2. Filtrado glomerular mayor o igual a 50 ml/minuto medido por CKD-EPI
3. Creatinina pre-ablación menor o igual a 2 mg/dl
4. Donantes entre 50 y 65 años sin presencia de insuficiencia renal aguda
5. Tiempo de isquemia funcional menor o igual a 30 minutos
6. Tiempo de isquemia caliente total menor o igual a 60 minutos
2. Filtrado glomerular mayor o igual a 50 ml/minuto medido por CKD-EPI
3. Creatinina pre-ablación menor o igual a 2 mg/dl
4. Donantes entre 50 y 65 años sin presencia de insuficiencia renal aguda
5. Tiempo de isquemia funcional menor o igual a 30 minutos
6. Tiempo de isquemia caliente total menor o igual a 60 minutos
2.3.- Exclusiones de receptores:
No serán incluidos en lista de distribución renal de órganos provenientes de donantes en asistolia aquellos potenciales receptores que presenten algunas de las siguientes condiciones:
1. Receptor menor de 14 años
2. Receptor hipersensibilizado sin registro de DSA
3. Receptor hipersensibilizado que presente DSA contra antígeno HLA del donante
4. Pacientes sin seroteca actualizada
5. Puntaje HLA menor a 2 (dos)
6. Receptores pediátricos en donantes mayores a 50 (cincuenta) años
2. Receptor hipersensibilizado sin registro de DSA
3. Receptor hipersensibilizado que presente DSA contra antígeno HLA del donante
4. Pacientes sin seroteca actualizada
5. Puntaje HLA menor a 2 (dos)
6. Receptores pediátricos en donantes mayores a 50 (cincuenta) años
2.3.- Aceptación del órgano:
1. La ACEPTACIÓN O RECHAZO del órgano ofrecido deberá efectuarse dentro de la primera hora de recibida la comunicación desde el INCUCAI o el Organismo Provincial de Ablación e Implante (OPAI), según corresponda, pudiéndose solicitar una extensión de una (1) hora.
2. La aceptación o rechazo del órgano ofrecido, por ubicación y evaluación del paciente, deberá efectuarse dentro de las dos (2) horas de recibida la comunicación desde el INCUCAI o el OPAI, según corresponda.
3. El INCUCAI o el OPAI establecerá y determinará el 'tiempo de corte' de la lista de distribución.
2. La aceptación o rechazo del órgano ofrecido, por ubicación y evaluación del paciente, deberá efectuarse dentro de las dos (2) horas de recibida la comunicación desde el INCUCAI o el OPAI, según corresponda.
3. El INCUCAI o el OPAI establecerá y determinará el 'tiempo de corte' de la lista de distribución.
2.4.- Ordenamiento en lista de distribución para trasplante renal:
La lista de distribución para trasplante renal se confeccionará según los siguientes criterios:
1. Regionalidad
1. Provincial: constituída por paciente inscriptos en Equipos de Trasplante con domicilio en la provincia generadora del donante, priorizándose pacientes con domicilio real en dicha provincia.
2 .Regional: constituída por paciente inscriptos en Equipos de Trasplante con domicilio en la región generadora del donante, priorizándose pacientes con domicilio real en la provincial generadora del donante.
3. Nacional: resto de los pacientes.
2. Edad del donante: los donantes menores de 18 años se distribuyen prioritariamente en los receptores pediátricos.
3. Categoría de Receptores:
1. Hipersensilizado
2. Cero Missmatch
3. Último Acceso Vascular
4. Orden de prioridad obtenido por el puntaje obtenido de la suma de:
1. Provincial: constituída por paciente inscriptos en Equipos de Trasplante con domicilio en la provincia generadora del donante, priorizándose pacientes con domicilio real en dicha provincia.
2 .Regional: constituída por paciente inscriptos en Equipos de Trasplante con domicilio en la región generadora del donante, priorizándose pacientes con domicilio real en la provincial generadora del donante.
3. Nacional: resto de los pacientes.
2. Edad del donante: los donantes menores de 18 años se distribuyen prioritariamente en los receptores pediátricos.
3. Categoría de Receptores:
1. Hipersensilizado
2. Cero Missmatch
3. Último Acceso Vascular
4. Orden de prioridad obtenido por el puntaje obtenido de la suma de:
1. Puntaje por edad: Receptor Pediátrico Resolución 341/21. ANEXO III punto 4.1 d) y Receptor Adulto Mayor 1.3.5. del presente anexo
2. Puntaje por tiempo en diálisis Resolución 341/21. ANEXO III punto 4.1 f) y 1.2 del presente anexo.
3. Puntaje donante vivo Resolución 341/21. ANEXO III punto 4.1 j.I
4. Puntaje trasplante previo no renal Resolución 341/21. ANEXO III punto 4.1 j.II
5. Puntaje por compatibilidad HLA Resolución 341/21. ANEXO III punto 4.1
2. Puntaje por tiempo en diálisis Resolución 341/21. ANEXO III punto 4.1 f) y 1.2 del presente anexo.
3. Puntaje donante vivo Resolución 341/21. ANEXO III punto 4.1 j.I
4. Puntaje trasplante previo no renal Resolución 341/21. ANEXO III punto 4.1 j.II
5. Puntaje por compatibilidad HLA Resolución 341/21. ANEXO III punto 4.1
En caso de de igual puntaje se priorizará a los potenciales receptores de la forma siguiente:
1. Receptores Último Acceso Vascular : antigüedad en dicha categoría
2. Receptores en categoría Trasplante Preventivo: antigüedad en lista de espera
3. Receptores hipersensibilizados y electivos: antigüedad en diálisis.
1. Receptores Último Acceso Vascular : antigüedad en dicha categoría
2. Receptores en categoría Trasplante Preventivo: antigüedad en lista de espera
3. Receptores hipersensibilizados y electivos: antigüedad en diálisis.
IF-2023-112558331-APN-DCT#INCUCAI